光のアンチバンチングとは、光の粒子性が強く現れる現象で、ごく大ざっぱに言えば、ほぼ同時に2個の光子を観測する確率よりも、少し時間をおいて1個ずつ光子を観測する確率の方が大きくなることです。式で表せば、ある時刻 t の電場強度を I(t) 、平均操作を〈…〉とすると、
〈I
2(t)〉< 〈I(t)I(t+Δt)〉…(1)
となります。
アンチバンチングが観測されるケースとして、共鳴蛍光があります。2つのエネルギー準位があり、励起状態から基底状態へ遷移する際に1個の光子が放出されますが、基底状態から再び励起状態に移行して次の光子が放出できるようになるまで時間が掛かるので、アンチバンチングが起きるわけです。
一方、レーザー光のようなコヒーレント光では、光の波動性が強く現れています。レーザー発振が生じるためには、励起状態にある多数の原子が協調して光を放出することが必要であり、各原子から1個ずつ光子が放出されるというモデルでは発振が起きる理由を説明できません。完全にコヒーレントな光では、
〈I
2(t)〉= 〈I(t)I(t+Δt)〉…(2)
となって、アンチバンチングは観測されません。
レーザー光を減衰させて、ある領域に存在する光子数の平均値が1個以下になるようにすることは可能です。しかし、もともとがコヒーレント光なので、強度 I の時間相関に関しては(2)式が成り立っており、この相関を壊さないように減衰させたとすると、やはりアンチバンチングは生じません。平均光子数が1になるように減衰させたレーザーを、光子を1個ずつ放出する(擬似的な)単一光子発生装置として扱うこともありますが、実際には、このレーザー光は厳密な単一光子状態ではなく、光子2個以上の状態もかなり含まれてしまいます(このことは、レーザー光を用いて量子暗号通信を行うとき、盗聴可能性という問題を引き起こします)。光子描像を使って表現すれば、光子は独立事象として(理想的なケースではポアソン分布に従うように)分布しており、どこかに集まる(バンチング)ことも、反発するかのように離ればなれになる(アンチバンチング)こともないのです。例えば、大きさの等しい2つの領域にあわせて2個の光子が存在するとき、各領域に1個ずつ存在する確率と、どちらかの領域に2個存在する確率は等しくなります。
パルス発振させたときの各パルスの状態は発振機構によって異なるので、一般的な議論は難しいと思いますが、仮に完全に独立した事象として取り扱えるならば、上の議論と同じくアンチバンチングは生じません。
【Q&A目次に戻る】

不確定性原理とは、位置の不確定性Δx と運動量の不確定性Δp が満たす不等式:
Δx Δp ≧ h/4π (h はプランク定数)
のことであり、この不等式を満たす範囲でならば、位置と運動量の同時測定も可能です。
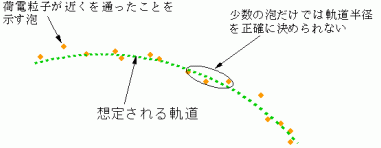
荷電粒子の運動量を測定するときに、良く用いられる方法が、泡箱内部に生じる粒子の飛跡を調べるというものです。泡箱内部には、沸点より高い過熱状態にした液体が入っています。ここに荷電粒子が入射してくると、その電離作用によって液体の原子がイオン化され、これを核とする泡が生じます。この泡は、近くを荷電粒子が通過したことを示すものなので、荷電粒子の正確な位置ではなく、ある不確定性を含む位置を表しています。
泡箱に磁場を加えておくと、ローレンツ力によって荷電粒子は回転運動をします。話を簡単にするため、荷電粒子の運動を平面内部に限定し、その面に垂直に磁束密度 B の磁場が加わっているとしましょう。ローレンツ力 F の公式:
F = qBv (q:電荷、v:速度)
と円運動の運動方程式:
F = mv
2/r (m:質量、r:軌道半径)
を組み合わせれば、運動量 p ( =mv )は、
p = qrB
と求められます。つまり、泡箱内部で荷電粒子が描く飛跡の半径を測定すれば、そこから直ちに運動量がわかる訳です。
ところが、泡箱で観測される飛跡は、あくまで、その近くを荷電粒子が通ったことを示す泡の集まりでしかありません。こうした泡の列は、図のように、想定される軌道の周囲に散らばった形で存在しています。このため、軌道半径 r を測定しようとしても、どうしても正確な値は得られず、ある不確定性が生じてしまいます。特に、荷電粒子の位置が軌道上のどこかになるかを確定しようとして、少数の泡だけに注目すると、そのときの軌道の形を決めるのが難しくなり、軌道半径 r の誤差が大きくなります。r の誤差は、上の式を介して運動量 p の不確定性をもたらすので、結局、位置の不確定性を小さくしようとすると運動量の不確定性が増えるという関係になるわけです。こうして、位置と運動量を同時に測定しているにもかかわらず、不確定性原理は満たされているのです(泡箱の実験では、位置と運動量の不確定性は、不確定性原理に現れる下限よりずっと大きな値になります)。
粒子の速度を測定する方法は他にもいろいろありますが、いずれの場合でも、位置と速度の双方に測定誤差などの不確定性が入り込んでしまい、不確定性原理を破るような測定値は得られません。
【Q&A目次に戻る】

ウィキペディアの「キログラム」の項目を見ると、「普遍的な物理量による定義へ」という小項目に次のように記されています。
現在の(国際キログラム原器を元にした)定義に変わる新しい定義の候補として、アボガドロ定数やプランク定数などを用いた各種の提案がある。
その中で最も有力なのが、一定個数のケイ素 (Si) 原子の質量をキログラムとするという原子質量標準である。アボガドロ定数の値をより正確に求めることができれば、そこからケイ素1キログラムに含まれるケイ素原子の数を決定することができる。…(中略)…現在、国際度量衡委員会 (CIPM) が中心となって、各国の研究機関でケイ素を用いてアボガドロ定数の不確かさを少しでも小さくするための研究が行われている。
かなりわかりにくい記述ですが、これは、ケイ素原子の質量によってキログラムを定義するという意味だと解釈されます。このとき、アボガドロ定数の値は誤差のない定義値になり、それに準じてモルの定義も変更になります。
キログラムを定義する際には、2つのものが必要です。1つは、一定値に定まった基準質量です。現在では、国際キログラム原器の質量が用いられていますが、物質の吸着などで変化していることがわかってきたので、ケイ素原子の質量(正確に言えば、基底状態にあるケイ素28原子の静止質量)のように、物理法則によって一定値になることが保証されているものに変更すべきだと考えられています。キログラムが定義されていない段階では、基準質量は数値で表せません(「質量分析器で測定したときの目盛りの値」のような形で表すことは可能です)。
キログラムの定義に必要なもう1つは、基準質量をキログラムに換算するための換算定数です。国際キログラム原器で定義するときには換算定数は1で良いのですが、ケイ素原子を基準質量として用いるならば、アボガドロ定数を含む換算定数が必要になります。このとき、1キログラムは、例えば「ケイ素28の質量÷28×アボガドロ数×1000」のように定義されます。
国際キログラム原器による定義を採用する場合、人間が勝手に決めた1キログラムが物理法則で定まる原子質量とどのような関係にあるのか、測定によって求めなければなりません。現在のアボガドロ定数が、6.02214179(30) × 10
23 という測定誤差を伴った値になっているのは、そのためです。しかし、ケイ素原子を用いてキログラムを
定義 するとなると、原子質量とキログラムの間の換算定数は、測定誤差のない「定義された値」になり、それに伴って、アボガドロ数の値も定義によって与えられます。この値は、さまざまな測定結果と矛盾しないように、当代の最高水準の測定データをもとに決められるはずです(現在、国際度量衡委員会が進めている「ケイ素を用いてアボガドロ定数の不確かさを少しでも小さくするための研究」は、このためのものでしょう)。さらに、「12グラムの炭素12に含まれる炭素原子数と同数の構成要素を含んでいるときの量」という現在の1モルの定義も破棄され、例えば、「原子が602214179000000000000000個集まった量」というように再定義されます。
上に記したウィキペディアの記述は2009年08月18日のもので、これ以後に編集によって書き換えられる可能性があります。
【Q&A目次に戻る】

ガンマ線の思考実験に基づくハイゼンベルクの議論は、不確定性原理の説明としては不適切です。電子の不確定性原理は電子の交換関係だけから導かれるものであって、測定とは無関係だからです。
ハイゼンベルクは、1927年の論文(「世界の名著 現代の科学II」(中央公論社)に収録)で不確定性原理に関する定性的な議論を展開していますが、そこでは、位置と運動量の不確定性が人間の知識に関するものであり、測定と不可分の関係にあるかのように論じられていました。しかし、この主張は、論文の草稿を読んだボーアによって厳しく批判されました。ボーアは、不確定性が電子に見られる粒子・波動の二重性に由来するとの立場を取り、ハイゼンベルクに論文の書き直しを要求したのです。ハイゼンベルクは、ボーアの見解を論文の末尾に追記しましたが、おそらく納得ずくではなかったのでしょう、1930年に出版した一般向けの啓蒙書『量子論の物理的基礎』では、再びガンマ線の思考実験を取り上げて、不確定性と測定を結びつける解釈を繰り広げています。一方、ボーアは、有名なコモ講演(1927)で粒子・波動の二重性と不確定性の関係を論じていますが、議論が晦渋でわかりにくいこともあって、一部の専門家以外には受け容れられなかったようです(そもそもボーアの主張自体が、ディラックの理論の受け売りだったと思われます)。
ハイゼンベルクの影響力は絶大でした。物理学的な基礎付けが不充分だったにもかかわらず、不確定性について非専門的な議論をするときには、ガンマ線の思考実験を持ち出すのが一種の定番になったのです。その結果、交換関係に由来する原理的な不確定性と、測定による状態の擾乱が混同されるという困った事態も起きています。不確定性原理についての真っ当な議論は、専門家向けの教科書(例えば、不確定性を測定に先立つ原理として論じたランダウ=リフシッツ『量子力学』の冒頭など)で読むことができますが、そこに到達する前に混乱してしまう人が少なからずいます。
不確定性原理をはじめとする量子力学の基礎を正しく理解するためには、ハイゼンベルクの呪縛から逃れることが必要でしょう。
この件に関しては、
小澤の不等式についての回答でも論じていますので、そちらも併せてお読みください。
【Q&A目次に戻る】

ドルトンが原子説を提唱したときは、気体の構成要素となる粒子は1つの原子だと考えていましたが、その後、アボガドロによって水素や酸素が2原子分子であることが示されました。
ドルトンの原子説の出発点になっているのは、倍数比例の法則です。例えば、メタン(現在の分子記号で表せばCH
4)とエチレン(同じくC
2H
4)の場合、ある炭素質量に対する水素の質量は、メタンを1とするとエチレンで2になります。このように、含まれる元素の種類が同じになる化合物の間で、元素の質量比が簡単な整数になることを、倍数比例の法則と言います。ドルトンは、この法則を簡単に導く作業仮説として、全ての物質は分割不能な原子から構成されるという原子説を提唱しました(著書の発行は1808年)。単体(特定の元素から成る物質)は1種類の原子の集合体、化合物は複数の原子が決まった個数(通常は1個ずつ)結合してできた複合原子の集合体であると考えたのです。この考えに従うと、水素ガスや酸素ガスは単体なので、1個1個の原子がバラバラに動き回っていることになります。
1809年に、ドルトン流の原子説では説明の付かない法則が発表されます。これが、ゲイ=リュサックによる気体反応の法則で、複数の気体が完全に反応する場合、温度・圧力が同じ状況下では気体の体積が単純な整数比をなすというものです。例えば、水素ガスと酸素ガスが反応して水蒸気になるとき、水素:酸素:水蒸気の体積比は 2:1:2 になります。ゲイ=リュサックは、この法則がドルトンの原子説と調和するものだと述べていますが、ドルトン自身は、水素と酸素は単原子、水蒸気は水素と酸素の原子が1個ずつ結合した複合原子から成るという考えに固執したこともあり、気体反応の法則を支持しませんでした(「同じような仮説を考えてみたことがあるが、放棄した」と記しています)。
原子説と気体反応の法則の矛盾を解消するために1811年に考案されたのが、アボガドロの分子説です。彼は、(1) 水素や酸素の粒子は同種の原子2個が結合した分子であり(他の化学種についても考察)、さらに、(2)温度・圧力が同じならば一定の体積に含まれる分子数が全ての気体で等しい(アボガドロの法則)と仮定することで、気体反応の法則を説明しました。現在の目で見ると、このアボガドロの説明は実に合理的に見えますが、ドルトンは気体の最小単位が1個の原子だという見方を変えようとしませんでした。化学者の大部分が分子説には批判的だったと言われています。
分子説を支持したのは、化学者よりもむしろ、気体粒子の運動論を研究していた物理学者たちです。すでに18世紀にダニエル・ベルヌイが「気体の圧力は粒子が壁に衝突することによって生じる」という考えを述べていますが、1810年代後半から、このアイデアと分子説を結びつけた気体分子運動論が力学的な理論として展開され始めます。この研究を通じて、気体分子の平均運動エネルギーが温度に比例すると仮定すればアボガドロの法則が導けることが明らかになり、分子説を支持する物理学者が増えていきます。
アボガドロの分子説が受け容れられる転機となったのが、1860年に開催された世界最初の国際的科学会議・カールスルーエ化学者会議です。後にメンデレーエフは、「アボガドロの法則はこの会議を通じて普及し、やがて人々の心を捉えることになった」と述べています。この時点で、化学者たちがまだ「原子は実在するか」「分子と原子の違いは何か」「(気体分子運動論に現れる)物理的分子と(化学反応に関与する)化学的分子は同一か」といった問題に拘泥していたのに対して、物理学者は、気体分子運動論に基づいて分子説を強く主張していました(マクスウェルによって分子速度の分布則が導かれ、気体分子運動論がほぼ完成するのは、会議の前年の1859年です)。そんな中で、カニッツァーロが化学的なデータをもとにした実証的な講演を行い、分子説の正当性を化学者が認めるきっかけをつくります。
カニッツァーロの議論は、大学での講義録 "SKETCH OF A COURSE OF CHEMICAL PHILOSOPHY" (英訳版がwww.archive.org で入手可)によって、ある程度まで知ることができます(
←ただし、講義録を一部しか読んでいないので、誤解があるかもしれませんが)。
まず、ある化合物の分子の質量(分子量)を定義します。温度・圧力・体積が同じ気体では分子数が等しいというアボガドロの法則に基づいて、ある温度・圧力の下で化合物が気体になったときの密度が分子量を表すと見なし、水素分子の分子量が 2 になるように単位を決めます。これは、アボガドロ数(6.02×10
23)個だけ分子を集めたときの(グラム単位の)質量として分子量を定義する現在のやり方に相当します(もっとも、慎重なカニッツァーロは、この値が分子の実際の質量だとは断言していませんが)。気体の密度が測定できるときには、これに基づいて化合物の分子量を直接決定し、それ以外は、化学反応における質量比から推測します。上に掲げた講義録では、このようにして得られたさまざまな化合物の分子量が、表にまとめられています。その上で、各化合物の分子を整数個の原子が結合したものと仮定し、原子の質量を求めていきます。
例えば、単体の臭素は、液体の重さを量ってから気化して体積を測定することで、分子量が 160 だと測定できます。一方、水素と臭素の化合物である臭化水素の分子量も、同様にして 81 と測定できます。2つの数値を見比べることで、単体の臭素は2原子分子、臭化水素は水素原子1個と臭素原子1個が結合したものと推測でき、臭素原子の質量が80だと求められます。
カニッツァーロは、このような方法で原子の質量と分子の構成が矛盾なく決定できることを示しました。これにより、分子・原子のリアリティが化学者の目にも明らかになった訳です。
【Q&A目次に戻る】

プルトニウムの化学毒性に関しては、いまだ充分に解明されている訳ではありません。これは、化学毒性よりも放射毒性の方がはるかに強いため、動物実験などのデータを元に化学毒性だけの効果を正確に評価するのが難しいからです。プルトニウムの急性毒性は、主に、骨表面に付着したプルトニウムからの放射線が骨髄に達して造血システムを破壊することに起因しており、化学反応による毒性の効果を覆い隠してしまいます。投与量を減らして長期間観察した場合でも、骨や肝臓に蓄積されたプルトニウムからの放射線によるガン(骨肉腫など)が発症してしまうため、化学的な作用による発ガン性があるかどうかもはっきりしません。専門家ではないので確言はできませんが、いくつかの文献に当たってみた限りでは、プルトニウムの化学毒性は、ウランなど他のアクチノイドと同程度だと推測されているようです(ウランより弱いという見方もあります)。
プルトニウムの物理的性質に関しては、最近になって新しい知見が得られています。アクチノイドは、通常、7s軌道に2個、6d軌道に1個の電子が入っており、5f軌道の電子数で区別されますが、プルトニウムの場合は、5f軌道の電子数が確定しておらず、4〜6個の状態が混じっているとのことです。プルトニウムの結晶には密度が大きく異なるものが複数あり、金属であるにもかかわらず電気伝導率が低いという特徴を持っていますが、こうした性質は、5f軌道の電子状態の不安定性に由来すると考えられています。
【Q&A目次に戻る】
©Nobuo YOSHIDA